3cer Periodo
Densidad
Toda solución química presenta, como mínimo, dos componentes: un soluto (el que es disuelto en el otro) y un solvente o disolvente (que disuelve al soluto). En el caso del azúcar disuelto en agua, el azúcar es el soluto y el agua es el disolvente.
La formación de soluciones y mezcla s de sustancias es fundamental para el desarrollo de nuevos materiales y para el entendimiento de las fuerzas químicas que permiten a la materia combinarse. Esto resulta de particular interés para los campos de la química, la biología y la geoquímica, entre otros.
Características de una solución química

En general, toda solución química se caracteriza por:
- Soluto y solvente no pueden separarse por métodos físicos como filtración o tamizado, ya que sus partículas han constituido nuevas interacciones químicas.
- Poseen un soluto y un solvente (como mínimo) en alguna proporción detectable.
- A simple vista no pueden distinguirse sus elementos constitutivos.
- Únicamente pueden separarse soluto y solvente mediante métodos como la destilación, la cristalización o la cromatografía.
Tipos de solución química
Las soluciones químicas pueden clasificarse de acuerdo a dos criterios.
La proporción entre el soluto y el disolvente:
- Diluidas. Cuando la cantidad de soluto respecto al solvente es muy pequeña. Por ejemplo: 1 gramo de azúcar en 100 gramos de agua.
- Concentradas. Cuando la cantidad de soluto respecto al solvente es grande. Por ejemplo: 25 gramos de azúcar en 100 gramos de agua.
- Saturadas. Cuando el solvente no acepta ya más soluto a una determinada temperatura. Por ejemplo: 36 gramos de azúcar en 100 gramos de agua a 20 °C.
- Sobresaturadas. Como la saturación tiene que ver con la temperatura, si incrementamos la temperatura, se puede forzar al solvente a tomar más soluto del que ordinariamente puede, obteniendo una solución sobresaturada (saturada en exceso, digamos). Así, sometida a un calentamiento, la solución tomará mucho más soluto del que ordinariamente podría.
El estado de agregación de los componentes:
Sólidas:
- Sólido en sólido. Tanto el soluto como el disolvente se encuentran en estado sólido. Por ejemplo: las aleaciones como el latón (cobre y zinc).
- Gas en sólido. El soluto es un gas y el disolvente es un sólido. Por ejemplo: hidrógeno en paladio, polvo volcánico, entre otros.
- Líquido en sólido. El soluto es un líquido y el disolvente es un sólido. Por ejemplo: las amalgamas (mercurio y plata)
Líquidas:
- Sólido en líquido. Por lo general, se disuelven pequeñas cantidades de sólido (soluto) en un líquido (disolvente). Por ejemplo: azúcar disuelto en agua.
- Gas en líquido. Se disuelve un gas (soluto) en un líquido (disolvente). Por ejemplo: el oxígeno disuelto en el agua de mar que es responsable de la vida acuática en el planeta.
- Líquido en líquido. Tanto el soluto como el disolvente son líquidos. Por ejemplo: las amalgamas (mercurio y plata)
Gaseosas:
- Gas en gas. Tanto el soluto como el disolvente son gases. En muchas ocasiones estas disoluciones se asumen como mezclas debido a las débiles interacciones entre las partículas de los gases. Por ejemplo: oxígeno en aire.
- Gas en sólido. El soluto es un gas y el disolvente es un sólido. Por ejemplo: polvo disuelto en aire.
- Líquido en gas. El soluto es un líquido y el disolvente es un gas. Por ejemplo: vapor de agua en el aire.
Concentración de una solución química
La concentración es una magnitud que describe la proporción de soluto respecto al solvente en una disolución. Esta magnitud se expresa en dos tipos distintos de unidades:
Unidades físicas. Aquellas que se expresan en relación al peso y al volumen de la solución, en forma porcentual (se multiplican por 100). Por ejemplo:
- %Peso/peso. Se expresa en gramos de soluto sobre gramos de solución.
- %Volumen/volumen. Se expresa en centímetros cúbicos (cc) de soluto sobre cc de solución.
- %Peso/volumen. Combina las dos anteriores: gramos de soluto sobre cc de solución.
Unidades químicas. Aquellas que se expresan en sistemas de unidades químicas. Por ejemplo:
- Molaridad (M). Se expresa en número de moles de soluto sobre un litro de solución o un kilogramo de solución. Se calcula de la siguiente manera:
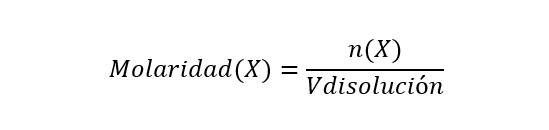
Donde n(X) es la cantidad de moles del componente X y Vdisolución es el volumen de la disolución. La molaridad se expresa en moles/Ldisolución.
- Fracción molar (Xi). Se expresa en términos de moles de un componente (solvente o soluto) en relación con los moles totales de la solución, de la siguiente manera:
Xsolución = moles de soluto / (moles de soluto + moles solvente)
Xsolvente = moles de solvente / (moles de soluto + moles solvente)
Siempre contemplando que:
Xsolvente + Xsolución = 1
La fracción molar es adimensional, es decir, no se expresa en unidades de medición.
- Molalidad (m). Es la proporción entre el número de moles de cualquier soluto disuelto por kilogramos de disolvente. Se calcula de la siguiente manera:
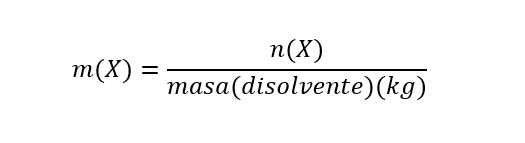
Donde m(X) es la molalidad de X, n(X) es el número de moles de X y masa(disolvente) es la masa de disolvente expresada en kg. Es importante aclarar que la molaridad se expresa por kg (1000g) de disolvente. Se expresa en unidades de mol/kg.
¿Qué es un mol?
Un mol es la unidad de la cantidad de una sustancia en el Sistema Internacional (SI). La cantidad de sustancia se expresa con el símbolo n, siendo el valor de un mol igual a 6,02214076 x 1023 unidades elementales. Es decir, un mol contiene 602 214,076 trillones de unidades elementales.
Como puedes ver, el mol indica un gran número de elementos. Esto le sirve a los químicos para poder expresar la cantidad de unidades que participan en una reacción. Para resumir y facilitar las cuentas, se usa 6,022 x 1023 .
Estas unidades elementales pueden ser: átomos, moléculas, iones, electrones o cualquier otro tipo de partículas. Así, un mol de átomos de hidrógeno contiene 6,022 x 1023 átomos de hidrógeno, un mol de moléculas de agua contiene 6,022 x 1023 moléculas de agua.
 Este número, 6,022 x 1023, se conoce como el número de Avogadro NA. Es una constante que representa la cantidad de sustancia y la cantidad de unidades en esa cantidad de sustancia.
Este número, 6,022 x 1023, se conoce como el número de Avogadro NA. Es una constante que representa la cantidad de sustancia y la cantidad de unidades en esa cantidad de sustancia.
Por ejemplo, 6,022 x 1023 átomos de carbono-12 (12C) tienen una masa de 12 gramos, mientras el mismo número de átomos de oro tiene una masa de 197 gramos.

Cómo calcular la cantidad de moles de una sustancia
Para calcular la cantidad de moles de una sustancia, se necesita el número de los objetos que se denota con la letra N mayúscula, la cantidad de moles que se denota con la letra n minúscula y la constante de Avogadro NA. Se utiliza la siguiente fórmula:
Por ejemplo, en un contenedor para hidrógeno se pueden almacenar 1,29 x10-24 de átomos de hidrógeno. ¿Cuántos moles son esta cantidad de átomos de hidrógeno?
Para calcular los moles de 1,29 x 10-24 átomos de hidrógeno, despejamos n de la fórmula anterior:
Sustituimos los valores y realizamos la operación:
La otra forma de calcular los moles de una sustancia es a través de la masa atómica o la masa molecular. Asî, la masa atómica (o molecular) es la masa de un mol de sustancia, que es igual a la masa de un átomo por el número de Avogadro:
Por ejemplo, la masa de un átomo de berilio es 1,4965 x 10-26 kg. Se quiere saber la masa atómica del berilio. Para eso multiplicamos la masa del átomo de berilio por el número de Avogadro:
Origen del mol
El uso de la palabra mol en química se origina del alemán y se empezó a usar a finales del siglo XIX.
El mol fue incluido en el Sistema Internacional de Unidades (SI) en 1971. Para ese momento, la definición del mol fijaba su valor en la masa molar del carbono-12:
El mol es la cantidad de sustancia de un sistema que contiene la misma cantidad de elementos como hay átomos en 0,012 kilogramos de carbono 12.
Vea también Estequiometría.
Ejercicios sobre moles resueltos
1. ¿Cuántos moles son 2,58 x 1024 moléculas de agua?
Aplicamos la fórmula
Respuesta: 2,58 x 1024 moléculas de agua son 4,28 moles
2. En un 1 ml de agua hay 3 x 1022 moléculas de agua, ¿Cuántos moles hay en 10 ml de agua?
Si en 1 ml de agua hay 3 x 1022 moléculas, en 10 ml habrá 30 x 1022 moléculas. Siguiendo la fórmula:
Sustituimos los términos conocidos:
Respuesta: en 10 ml de agua hay 0,49 moles de moléculas.
3. ¿Cuántos moles hay en 10,02 gramos de calcio?
El peso atómico del calcio es igual a 40,08 g/mol, es decir, que en 40,08 gramos de calcio hay 1 mol. Así, para calcular los moles que hay en 10.02 gramos de calcio hacemos la siguiente relación:
Respuesta: en 10,02 gramos de calcio hay 0,25 moles de átomos de calcio.
4. ¿Cuántos átomos hay en 2 gramos de oro?
El peso atómico del oro es igual a 197 gramos por mol, esto significa que en 197 gramos hay 6,022 x 1023 átomos de oro. Así, para determinar cuántos átomos hay en 2 gramos de oro, hacemos la siguiente relación:
Luego, Noro el número de átomos de oro en 2 gramos será:
Respuesta: en 2 gramos de oro hay 6,114 x 1021átomos.
La biología de los microorganismos
El descubrimiento de los microorganismos ocurrió hace poco más de 300 años con las observaciones de Robert Hooke y Antony van Leeuwenhoek, siendo Leeuwenhoek quien inició la investigación de la vida microscópica. Sus observaciones de lo que llamó “animálculos” como escribió en sus cartas enviadas a la Royal Society de Londres, realizadas a través de un microscopio simple, se conservan hasta hoy como documentos históricos.
No obstante, la humanidad ya utilizaba microorganismos mucho antes de que supiera que existían, por ejemplo, en la elaboración de alimentos como el pan. Aunque también percibían sus efectos perjudiciales sin saber qué los provocaba, como enfermedades causadas por microorganismos patógenos.
Los microorganismos son seres vivos muy pequeños que sólo se pueden ver a través de un microscopio, empero participan en diversos procesos metabólicos, ecológicos y biotecnológicos convirtiéndose en un factor clave para el funcionamiento de los sistemas biológicos y el mantenimiento de la vida en la Tierra. Se reconoce que existe una gran diversidad biológica, por ejemplo, de hongos se han descrito 70, 000 especies, aunque se pronostican hasta dos millones. Asimismo, poseen una rápida capacidad para adaptarse a los cambios ambientales debido a su historia evolutiva, ya que las archaeas, un grupo de éstos microorganismos, son consideradas como las primeras formas de vida en el planeta. Su capacidad y eficiencia metabólica les permitieron colonizar la superficie terrestre, el aire, los lagos salados y prácticamente todas las regiones geográficas del planeta.

Izquierda. Retrato de Antony van Leeuwenhoek (1632-1723). Óleo sobre lienzo de Jan Verkolje.
Derecha. Réplica de Jeroen Rouwkema del Microscopio simple de Leeuwenhoek. La muestra se colocaba en la punta del tornillo, en frente de la única lente, que destaca por la pequeñez de su diámetro.
Otra de sus características importantes es que pueden vivir solos o en asociación con otros seres vivos. En las plantas viven hongos y bacterias sin causarles daño, tal es el caso de los hongos micorrícicos en las raíces de las plantas, o de la bacteria Rhizobium, un simbionte de las leguminosas.
Son también los principales responsables de la descomposición de la materia orgánica y del ciclaje de los nutrientes como el carbono, permitiendo el funcionamiento de los ecosistemas. En seres humanos también existen bacterias en elevada densidad, como es el caso de Escherichia coli en el colon del intestino humano.
Aunque en la actualidad se sabe que muchas de las enfermedades infecciosas que afectan a la humanidad son causadas por microorganismos, bacterias, hongos y virus principalmente, también es importante recordar que los antibióticos son producidos por ellos mismos, y que son de enorme importancia médica, como la penicilina, sintetizada por los hongos Penicillium notatum y P. chrysodenum. También es posible formular las vacunas, con las cuales las personas y animales quedan protegidos de ciertos microorganismos evitando así que puedan contraer enfermedades causadas por ellos. El conocimiento y comprensión del metabolismo de estos seres vivos proporciona herramientas para entender y curar muchas enfermedades que antiguamente eran mortales. Las bacterias también se han utilizado en la industria alimentaria como ocurre con el género Lactobacillus usado en la producción de vitamina B12 en el yogurt.

Vista con microscopio de luz a 40X, del hongo del género Cladosporium sp. incorporándose a las fibras de un papel industrial.
Clasificación.
Los microorganismos se agrupan de forma general en dos categorías: procarióticos y eucarióticos. En la primera están las archaeas y las bacterias, mientras que en la segunda se encuentran hongos, algas y protozoarios. No obstante, de manera convencional los virus, viroides y priones son también considerados microorganismos.
Algunas características del primer grupo es que son células simples diferentes en su organización interna a las eucariotas, su tamaño es entre 1 y 10 micrómetros, carecen de núcleo y organelos celulares, tienen una molécula única de ADN circular, membrana celular, y pared celular de peptidoglucano. Por otro lado, las células eucariotas son más complejas que las procariotas, de tamaño superior, entre 10 a 100 micrómetros, tienen un núcleo con membrana y nucléolo, ADN lineal que forma cromosomas, organelos rodeados por membranas, membrana celular.
Dada su gran diversidad, existen algunas clasificaciones más específicas de acuerdo a otras características propias de los microorganismos como la reproducción, la respiración, el crecimiento, y su nutrición.
Microorganismos en los Archivos.
Los procesos biológicos de los microorganismos causan efectos de degradación en diversos materiales de uso común, como el papel. Uno de los lugares donde se pueden evidenciar dichos daños es en los acervos documentales o archivos, siendo muchos de ellos de interés internacional, debido a su aportación histórica. Los documentos están expuestos permanentemente a sufrir alteraciones físicas, químicas y/o biológicas. Esta última se puede nombrar como biodeterioro, que se define como cualquier cambio indeseable en las propiedades de un material causado por las actividades vitales de los organismos. La forma específica de biodeterioro causada por el desarrollo de los microorganismos se denomina microbiodeterioro.
La causa del microbiodeterioro más recurrente en soportes de papel en los archivos es causada principalmente por hongos filamentosos o miceliares, entre los que se encuentran los géneros Aspergillus, Cladosporium, Alternaria, Penicillium, y Fusarium. Por ejemplo, la especie Aspergillus Niger del género Aspergillus, genera manchas de distintos colores desde amarillo, rosa intenso, morado hasta el negro. Asimismo, el género Penicillium, genera manchas verdes, azules o amarillas. Entre las bacterias más comunes en los archivos están los denominados Actinomycetes.
Dada su importancia en los archivos documentales, se describen de forma general algunas de las características de los hongos miceliares o filamentosos.

Efectos de los microorganismos sobre documentos. Archivo Histórico del Estado de Oaxaca.
Estructuras de hongos filamentosos.
Los hongos son seres eucariotas que pueden ser pluricelulares (hongos miceliares) o unicelulares (levaduras), ambos se incluyen en el concepto de hongos microscópicos. Los hongos miceliares o mohos, en su desarrollo forman una estructura vegetativa y una reproductora, en la primera es donde se pueden diferenciar las hifas, que son cada uno de los filamentos en forma de tubos finos y largos que entrelazados forman el micelio. La segunda estructura es cuando ya se ha formado el micelio, y su forma de reproducción es mediante la formación de esporas asexuales o conidios, pudiendo multiplicarse asexual o sexualmente. Si el proceso de reproducción es asexual, el conidio o espora asexual una vez madura se desprende y en condiciones ambientales adecuadas germina dando lugar a un nuevo hongo micelar. En el proceso sexual, dos células de signo complementario se recombinan y originan las esporas sexuales capaces, en condiciones medio-ambientales favorecedoras, de formar nuevas colonias fúngicas.
Es por ello que su desarrollo y crecimiento están estrechamente relacionados con las condiciones ambientales, siendo la humedad relativa (HR) y la temperatura dos de los factores más importantes. Este tipo de biodeterioro es quizás la causa más difícil de detectar de modo anticipado, por ello las medidas preventivas y de control o monitoreo, son fundamentales para evitar su propagación en los archivos.
La humedad relativa por si sola es una causa extrínseca que hay que destacar en relación a los documentos, ya que una humedad excesiva, mínima o fluctuante afecta este soporte de diversas formas y cuantiosamente. Entre otras alteraciones además de la contaminación biológica, favorece la incorporación de oxígeno y gases activos, el hinchamiento de las fibras, la pérdida de solidez y elasticidad y deformaciones. Las principales alteraciones que los hongos provocan a los soportes documentales son: degradación enzimática de la celulosa y de las proteínas, la excreción de ácidos y pigmentos, así como la acción mecánica sobre el papel.
Con una humedad baja, el soporte se encoge e incluso puede perder resistencia, craquelándose y perdiendo flexibilidad. Las oscilaciones provocan dilataciones y contracciones que pueden producir rotura y cristalización de la celulosa. El crecimiento de microorganismos se desarrolla a una humedad relativa mayor a 65, es por ello que los parámetros ambientales recomendados de humedad relativa es máxima de 65 y mínima de 45, y una temperatura máxima de 22 y mínima de 15.
Los hongos a bajas temperaturas paralizan su metabolismo y su desarrollo, permaneciendo latentes hasta que las condiciones medioambientales vuelven a ser las adecuadas para su crecimiento. Si se disminuye la temperatura, es imprescindible que la HR también disminuya, ya que en caso contrario podría provocarse una rápida proliferación. Sin embargo, también puede llegar a aparecer un brote fúngico a una temperatura superior de 62ºC, con un aumento de temperatura, los microorganismos pueden desarrollarse a una HR más reducida.
Nutrición.
Los microorganismos necesitan sintetizar los nutrimentos necesarios para su desarrollo a partir de otros, siendo el papel, utilizado como fuente nutricional, ya que está compuesto de fibras vegetales y la celulosa es la principal fuente, también están los aditivos funcionales como los encolantes y tintas con aglutinantes orgánicos, utilizadas en la encuadernación y durante la elaboración del papel. Cuando la contaminación de microorganismos proviene desde la manufactura se le denomina infección primaria, posterior a ella, se le designa como infección secundaria. Los hongos afectan los distintos sustratos orgánicos, naturales o sintéticos, además de la celulosa están los policarbonatos, metales, componentes de soportes ópticos y magnéticos como el CD y los VHS, el cartón, fotografías, pinturas, textiles, cuero, plásticos, madera, entre otros.
Las alteraciones que pueden provocar pueden ser de tipo químico o físico, como alteraciones cromáticas y de textura del soporte, a causa de la secreción de enzimas, la acidificación del papel por la excreción de ácidos orgánicos que hidrolizan de los sustratos de los que se nutren, también se le relaciona con las manchas de deterioro tipo foxing. Así, su gran versatilidad metabólica les permite degradar los diversos materiales incluso sin entrar en contacto físico con ellos.

Vista macroscópica de hongos micelares (mohos). Impacto sobre el soporte de papel por una humedad relativa fuera del rango recomendado.

Integración de refuerzos en documentos con un alto grado de microbiodeterioro, realizado en el Departamento de Conservación y Restauración del Archivo Histórico del Estado de Oaxaca.
Propagación.
La propagación de los hongos se realiza por medio de los conidios o esporas. Estas estructuras se transportan con facilidad por el aire. La limpieza de los espacios y una adecuada ventilación son muy importantes para prevenir la dispersión de microorganismos debido al polvo que pueda acumularse en los recintos. El polvo tiene una composición heterogénea y variable formada por partículas químicas, huevos de insectos, polen, conidios y esporas, entre otros, llegando a reportarse en estudios de depósitos, niveles superiores a 8000 Unidades Formadoras de Colonia UFC por m3 de esporas fúngicas, que es considerado un nivel máximo.
Cabe mencionar que, de acuerdo a la normatividad de los Archivos, la Estabilización es una de los procedimientos preventivos más importantes para la mitigación en la propagación de hongos, el cual consiste en la limpieza de documentos, fumigación, integración de refuerzos, extracción de materiales que deterioran y oxidan el papel, así como el resguardo de documentos sueltos en papel libre de ácido.
Investigación.
Es así, que el conocimiento y comprensión del metabolismo de los microorganismos es primordial, asimismo, los factores principales a considerar para prevenir y mitigar los efectos perjudiciales que debido a los procesos biológicos de los microorganismos pueden afectar a los bienes materiales y al ser humano son: los parámetros de humedad y temperatura, la composición de los materiales en los espacios, la iluminación y exposición del objeto, así como la manera y frecuencia de la limpieza, junto con las condiciones de ventilación. A pesar de la importancia de los microorganismos en la vida del hombre, la investigación microbiológica es aún incipiente en México, considerado particularmente un país mega diverso.


Comentarios
Publicar un comentario